摘 要 : 测定了 Ti H2 在不同温度下的分解曲线 ,从热力学和动力学的角度对 Ti H2 的分解规律进行了研 究 ,并分析了使用 Ti H2 制备泡沫铝时的应用方式 ·结果表明 : Ti H2 的分解率随着温度的升高而逐步提高 , Ti H2 的分解过程大致可分为三个阶段 ·在 620~680 ℃范围内 , Ti H2 在前 10 min 分解激烈 ,在 10~20 min 内 Ti H2 的分解速度变得缓慢 ,在 20 min 以后 Ti H2 的分解逐渐趋于停滞·在 700~720 ℃之间 , Ti H2 在前 6 min 内的分解速度很快 ,在 6~10 min 之间分解速度降低 ,在 10 min 以后分解反应出现停滞 ·
关 键 词 : 氢化钛 ;分解曲线 ;熔体发泡 ;泡沫铝 ;制备
中图分类号 : T G 146 . 2 文献标识码 : A 文章编号 : 1005-3026(2007) 01-0087-04
Decomposition Behavior of Ti H2 and Its Application to Fabricating Al uminum Foam
L U O Hong-jie , JI Hai-bi n , YA NG Guo-j u n , YA O Guang-ch u n
( School of Materials & Metallurgy , Nort heastern University , Shenyang 110004 , China . Correspondent : L UO Hong-jie , E-mail : luohj @ smm . neu . edu . cn)
Abstract : The decomposition curves of Ti H2 were determined at different temperat ures , and how to decompose Ti H2 was st udied t hermodynamically and kinetically . The way to use Ti H2 as foaming agent to prepare aluminum foam was al so discussed . The result s showed t hat t he decomposition rate of Ti H2 increases wit h increasing temperat ure , and t he decomposition process of Ti H2 can be divided into t hree phases in a cert ain temperat ure range . In t he range from 620 ℃ to 680 ℃ , t he decomposition of Ti H2 i s violent for 10min after st arting , t hen t he decomposing speed becomes slow during t he next 10 min and t he decomposition tends to st agnate after 20 min . In t he range from 700 ℃to 720 ℃ , t he decomposing speed of Ti H2 becomes very rapid for 6 min after st arting , t hen decelerates during t he next 4 min and st agnates later .
Key words : Ti H2 ; decomposition curve ; foaming in melt ; aluminum foam ; preparation
氢化钛( Ti H2 ) 属于一种金属型氢化物 ,其本 身可以作为储氢材料 ,利用其脆性及在真空高温 下的脱氢行为 ,还可以用它来制备高纯钛粉和氢 气 ·随着泡沫金属研究的兴起 ,氢化钛作为一种高 效的发泡剂开始引起人们的注意 ,尤其在制备泡沫铝的过程中 ,氢化钛的发泡作用至今尚无法被其他发泡剂所取代·
铝熔体泡沫化过程的动力源于 Ti H2 的热分 解 , Ti H2 的分解行为直接关系到熔体中气泡的形 成 、生长 , 以及泡孔直径大小和孔壁厚度等制备泡 沫铝的工艺和性能参数 , 因此 , 在研究泡沫铝之 初 ,首先要进行 Ti H2 分解反应的热力学和动力学方面的研究,涉及TiH2分解反应方面的研究可以归纳为如下几个方面 : 方法一是采用热重法 ( T G) 测量 Ti H2 的失重曲线[ 1 - 2 ] ,进而得到 Ti H2 分解反应过程的变化趋势及反应的起始温度和结束温度 ;方法二是采用差热分析法 (D TA) 或差示 扫描量热法(DSC) 测量 Ti H2 的分解曲线[ 3 - 4 ] ,根 据曲线的吸 ( 放) 热峰值的出现定量地确定 Ti H2 快速反应的温度区间和极值点 ;方法三是采用热 脱附谱法(TDS) 做出 Ti H2 分解图[ 5 - 6 ] ,从中获得 Ti H2 分解速率达到最大值时的分解温度 ·采用上 述方法得到的测量结果 , 揭示了 Ti H2 分解的一 般规律 ,在理论上对研究泡沫铝的制备工艺具有重要的指导意义 , 但这些测量 Ti H2 热分解反应 的方法属于一 种动态的分析方法 , 即 Ti H2 的分解速率随着温度 、时间的变化而变化 ·然而 ,在实 际制备泡沫铝的过程中铝熔体的温度基本是不变 的 ,所以采用静态的分析方法测量 Ti H2 的分解 速率更加贴近于制备泡沫铝的实际情况 ·本研究 首先在某一特定温度下测定 Ti H2 的分解率与时 间的关系曲线 , 然后进一 步分析 Ti H2 的分解方式及过程的控制环节 , 目的在于指导铝熔体的泡 沫化行为·
1 实验方法
实验采用失重法测量 Ti H2的分解曲线 , 并 在一套自制的程序控温管式加热装置中进行·实 验过程是 :首先将管式炉升温 , 当炉内反应区的温 度达到设定的分解温度之后通入高纯氩气 ( 纯度 为 99 .999 %) , 流 量 为 50 mL/ min ; 然 后 将 2 g Ti H2 粉末(61 μm) 放入悬挂在电子天平之下的特 制烧舟之中 ,并将烧舟置于管式炉内的预热区(温 度 < 400 ℃) 预热 ;当炉内反应区温度再次恒定于 设定的分解温度之后 ,把烧舟从预热区快速移至 反应区 ;将电子天平清零 , 以后每隔 1 min 读取一 次反应所失去的质量 ,数据采集卡将记录的数据 送入计算机并绘出失重曲线·
在实验中为了降低误差造成的影响 , 需要预先确定反应区和预热区的具体位置 ·反应区的位 置即是热电偶测温点的位置 ,预热区的位置需要 在预备实验中用热电偶进行测定 ,在分解实验中 通过控制管式炉的升降来保证烧舟处于正确的位置·烧舟和吊丝也要在分解反应温度下进行预处 理 , 以便在分解实验中烧舟和吊丝的质量不会发 生改变 ·由实验观察可知 ,将烧舟由预热区移至反 应区所引起的反应区温度波动为 ±1 ℃ ·
2 实验结果与讨论
分别测定了 620 ,640 ,660 ,680 ,700 ,720 ℃下 Ti H2 的分解曲线 , 并得到如图 1 所示的 Ti H2 分 解反应的分解率随时间变化的关系曲线 ·
由图 1 清 楚 地 看 到 , 随 着 反 应 温 度 的 升 高 Ti H2 的分解率逐步提高 ·在 620~680 ℃区间内 , Ti H2 分 解 率 上 升 的 幅 度 相 对 较 小 , 但 在 680 ~ 700 ℃之间产生较大的跃升幅度 ,在 700~720 ℃之间分解率的上升幅度重新变小 ·
从图 1 可以看出 , Ti H2 的分解反应大致可分 成三个阶段 ·在 620~680 ℃ , Ti H2 在前 10 min 分解激烈 , 曲线斜率较大 ;在 10~20 min 内 Ti H2 的 分解速度变得缓慢 , 曲线斜率变小 ; 在 20 min 以 后 Ti H2 的分解逐渐趋于停滞 ·而在 700~720 ℃ 之间 , Ti H2 在前 6 min 内的分解速度很快 , 在 6 ~10 min 之间分解速度降低 , 在 10 min 以后分解反应出现停滞 ·
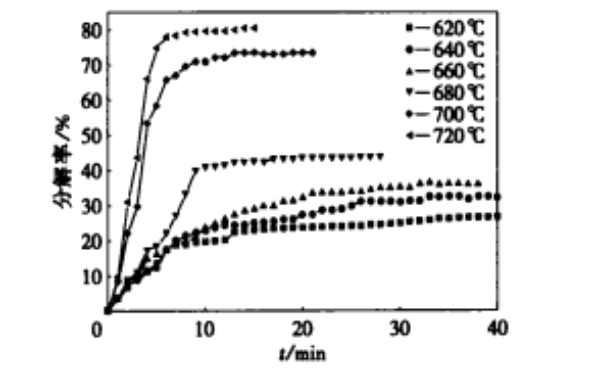
图 1 TiH2 分解率 - 时间关系曲线
Fig . 1 Relationship between decompo sition
rat e of TiH2 and time
2 . 1 氢化钛分解反应热力学分析
对于 Ti H2 在不同温度下分解所表现出的特 征 ,可从热力学的角度加以说明 ·图 2 是 Ti H2 粉 末(61 μm) 的差热分析图 ·图 2 表明 ,在 600 ℃附 近曲线出现一 个吸热峰 , 说明 Ti H2 在此温度附 近分解剧烈 ·由于实验选定的温度均高于 600 ℃ , 所以 Ti H2 在开始反应阶段均表现出激烈的分解 行为 ,而在中后期分解反应逐渐趋于平稳 ·图 1 中 620 ,640 ,660 ,680 ℃ 4 个温度下 Ti H2 的分解行为基本与差热分析得到的结果相符 , 但在 700 ,720 ℃ 2 个温度下 Ti H2 分解率的明显上升 ,却难 以从图 2 中给出相应的解释 ·李光明等人在研究 Ti H2 的制备及其分解中所做的差热分析图显示 , Ti H2 在 680 ℃时出现一个吸热峰[ 4 ] ·该吸热峰的存在很好地解释了Ti H2 在 680 ,700 ℃2 个温度下分解率差别较大的原因 , 即 Ti H2 在 680 ℃左右 出现的第二个吸热峰使得其在 700 ,720 ℃下的分
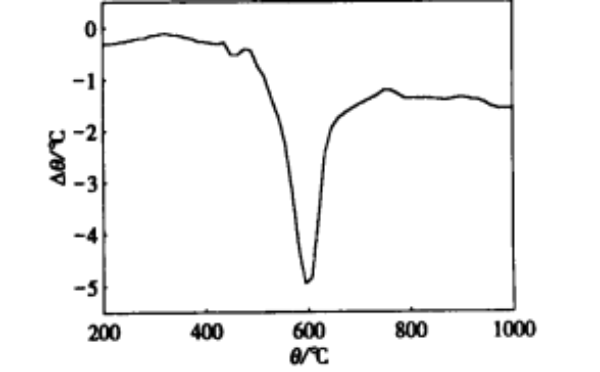
图 2 TiH2 差热分析图
Fig . 2 Diferential thermal analysi s of TiH2
由反应式(4) 可知 , Ti H2 分解反应发生后生成了 单质 Ti , Ti H2 颗粒将被逐渐形成的 Ti 层包围 ,分 解析出的 H2 需穿过 Ti 层向外扩散 ,所以 Ti H2 分 解是一个多相反应 ,存在相界面 ·根据气 - 固反应 机理 , Ti H2 分解反应包括以下三个环节 :
(1)在反应物和生成物界面( Ti H2-Ti) 上发 生的结晶化学反应 ;
(2) 气体产物 H2 穿过生成物 Ti 层的内扩 散 ;
(3) H2 穿过 Ti 表面边界层的外扩散 ·
气 - 固相反应的各环节虽然是连续完成的 , 但各环节的速度是不相等的 , 总的反应速度取决 于最慢的一个环节 , 即限制性环节 ·在 Ti H2 分解 实验中 , 由于反应温度较高且有上升气流存在 (Ar 气保护气流) , H2 的运动速度要高于 Ti 表面 边界层的临界流速 , H2 的外扩散不会成为限制性 环节 , 因此限制性环节主要存在于内扩散和结晶化学反应两个阶段 ·
图 3 是 Ti H2 颗粒的扫描电镜照片 ·可以看 到 , Ti H2 为多面体 ,结构比较致密 ,存在形状规整

图 3 TiH2 颗粒扫描电镜照片
Fig . 3 SEM image of TiH2 particles
的相界面 ·随着分解反应的进行 , Ti H2 颗粒将逐 渐缩小 ,相界面随时间的延续逐渐向内收缩 ,而生 成物 Ti 层的厚度增大 ,所以 , Ti H2 的这种分解方式符合收缩核模型的典型特征 ·
Ti H2 的收缩核模型可用图 4 表示( 为简化起见,将TiH2 颗粒近似看成球形)
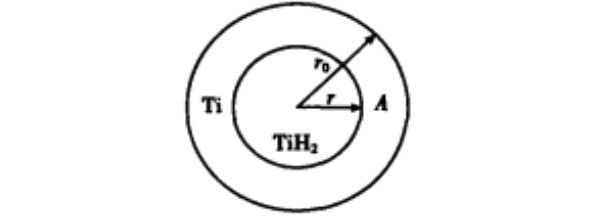
图 4 TiH2 收缩核模型示意图
Fig . 4 Schematic s of nuclear model of TiH2 particle
图 4 中小圆代表 Ti H2 内核 ;大圆和小圆之间 的圆环代表生成的 Ti 层 ; r0 为 Ti H2 颗粒的原始 半径 ; r 为收缩后的内核半径; A 为反应界面面积 ( A = 4πr2 ) ·在 Ti H2 分解反应初期 ,生成物 Ti 层 很薄 ·由于分解反应析出了 H2 , 因而生成物 Ti 层 也比较疏松 ,这时内扩散速度快 ,反应处于结晶化 学反应控制阶段 ·在 Ti H2 分解反应后期 , 由于生 成物 Ti 层增厚并且变得致密 , 反应产生的 H2扩散速度变小 , 内扩散成为控制环节 ·
从动力学的角度进一步分析图 1 中 Ti H2 的 分解曲线表明 ,温度对于化学反应时间的长短和 分解率的高低具有决定性的作用 ·在 620~680 ℃ 区间内 , 由于温度相对较低 ,化学反应速度较慢 , 结晶化学反应和内扩散的控制时间相对较长 , 分 解反应前两个阶段时间之和为 20 min , Ti H2 的分 解率低于 45 % ·当分解温度在 700~720 ℃之间 时 ,化学反应速度加快 ,结晶化学反应和内扩散的控制时间缩短 ,表现为分解反应前两个阶段的时 间之和为 10 min ,但 Ti H2 的分解率可高达 80 % ·
3 应用分析
Ti H2 在不同温度下的 热 分 解 曲 线 , 对 于 以 Ti H2 为发泡剂来制备泡沫金属而言均具有一 定 的指导意义 ,尤其对熔体发泡法制备泡沫铝更具 有直接的应用价值 ·采用熔体发泡法制备泡沫铝 时 ,熔体的搅拌及发泡温度一般均控制在 630~ 720 ℃范围之内[ 7 - 10 ] ,实验中以此为依据选取了 Ti H2 的分解温度 ·根据实验得到的 Ti H2 分解曲 线 ,可以在铝或铝合金熔体泡沫过程中通过改变 工艺条件来控制 Ti H2 的分解速度 , 进而控制泡 沫铝的泡孔结构 ·在制备低密度泡沫铝材料时 ,可以适当降低铝基熔体的搅拌温度 , 由于在低温下 Ti H2 分解 率较低 ,这时搅拌主要起到使发泡剂均匀分散的 作用 ·在搅拌完成之后 ,相应提高熔体的发泡温度 则可以获得低密度的泡沫铝材料 ;相反 ,在制备高密度泡沫铝材料时 , 需要提高熔体的搅拌和发泡 温度 ,控制熔体的泡沫化程度 ,得到高密度的泡沫铝材料 ·在熔体搅拌 、发泡温度确定之后 ,还需要控制影响熔体泡沫化行为的其他因素 ·以熔体搅拌为 例 ,选取特定形状的搅拌桨可以获得良好的紊流 效果 ,而合适的搅拌桨尺寸可以使熔体既具有一 定的体积流量 ,不出现搅拌死角 ,又有较大的剪切 力 ,破坏发泡剂的团聚 ,最后达到使发泡剂充分分 散并悬浮于熔体之中的目的 ·在正确选取了搅拌桨的形状 、尺寸之后 ,搅拌时间 、搅拌速度的确定 则与 Ti H2 分解过程中结晶化学反应 、内扩散之 间有着密切的关系 ·搅拌时间同时影响结晶化学 反应和内扩散两个环节 ,搅拌速度则直接影响内 扩散的速度 ,在高速搅拌的情况下 ,可以缩短搅拌时间 ·虽然需要控制的因素还有很多 ,但都可围绕 Ti H2 分解这一关键条件而进行相应的调整和确定 ·
4 结 论
( 1) Ti H2 的分解率随着温度的升高逐步提 高 ·在 620~680 ℃区间内 , Ti H2 分解率上升的幅 度相对较小 ,但在 680~700 ℃之间产生较大的跃 升幅度 ·
(2) Ti H2 的分解反应大致可分为三个阶段 · 在 620~680 ℃范围内 , Ti H2 在前10min 分解激烈 ,在 10~20 min 内 Ti H2 的分解速度变得缓慢 , 在 20 min 以后 Ti H2 的分解逐渐趋于停滞 ·在 700 ~720 ℃之间 , Ti H2 在前 6 min 内的分解速度很 快 ,在 6~10 min 之间分解速度降低 ,在 10 min 以后分解反应出现停滞。
参考文献 :
[ 1 ] Yang C C , Nakae H. Foaming characteristics control during production of aluminum alloy foam [ J ] . Jou rnal of A lloys and Compou nds , 2000 ,313 :188 - 191 .
[ 2 ] Gergely V , Curran D C , Clyne T W . The FOAMCARP process : foaming of aluminium MMCs by t he chalk- aluminium reaction in precursors[J ] . Composites Science and Tech nology , 2003 ,63 :2301 - 2310 .
[ 3 ] Kennedy A R . The effect of Ti H2 heat treat ment on gas release and foaming in Al-Ti H2 preforms [ J ] . Script a Materi alia , 2002 ,47 :763 - 767 .
[ 4 ] 李光明 ,甘礼华 , 陈龙武 ,等 ·氢化钛的制备及其分解 [J ] ·应用化学 , 1998 , 15( 1) :77 - 79 ·
(Li Guang-ming , Gan Li-hua , Chen Long-wu , et al . The formation and decomposition of titanium hydride [J ] . Chi nese Jou rnal of Applied Chemist ry , 1998 , 15 ( 1) :77 - 79 . )
[ 5 ] Zeppelin F V , Hirscher M , Stanzide H , et al . Desorption of hydrogen from blowing agent s used for foaming metals [ J ] . Composites Science and Tech nology , 2003 , 63 : 2293 - 2300 .
[ 6 ] 杨东辉 ,何德坪 , 杨上闰 ·氢化钛热分解反应动力学及铝合金熔体泡沫化研究[J ] ·中国科学 :B 辑 , 2004 , 34 ( 3) : 195 - 201 ·
( Yang Dong-hui , He De-ping , Yang Shang-run . The study on kinetics of Ti H2 t hermal decomposition and foaming of aluminum alloy melt [J ] . Science i n Chi na : Series B , 2004 , 34 ( 3) :195 - 201 . )
[ 7 ] Yang C C , Nakae H. The effect s of viscosity and cooling conditions on t he foamability of aluminum alloy[J ] . Jou rnal of Materi als Processi ng Tech nology , 2003 , 141 :202 - 206 .
[ 8 ] 王政红 , 陈派明 ·发泡法制备泡沫铝 [J ] ·材料开发与应用 , 1998 , 13 ( 3) :30 - 32 ·
( Wang Zheng-hong , Chen Pai-ming . Fabrication of foamed aluminum by foaming technique [ J ] . Materi al Develop ment and Application , 1998 , 13 ( 3) :30 - 32 . )
[ 9 ] Akiyama S , Ueno H , Imagawa K , et al . Foamed metal and met ho d of producing same : US , 4713277 [ P ] . 1987 - 12 -15 .
[ 10] 罗洪杰 ,姚广春 ,刘宜汉 ,等 ·粉煤灰增黏制备泡沫铝材料的研究[J ] ·东北大学学报 : 自然科学版 , 2005 , 26 ( 3) : 274 - 277 ·
( L uo Hong-jie , Yao Guang-chun , Liu Yi-han , et al . Fabrication aluminum foam wit h fly ash as viscosifier [ J ] . Jou rnal of Nort heastern Uni versity : Nat u ral Science , 2005 ,26 ( 3) :274 - 277 . )